INTRODUCCIÓN
En el proceso de envejecimiento, tanto normal como patológico, ocurre una serie de cambios significativos a nivel cerebral, cambios que impactan la función cognitiva y motora. Una de las manifestaciones más evidentes del envejecimiento cerebral es la pérdida progresiva de volumen, especialmente en la sustancia gris, la cual es crucial para funciones cognitivas y motoras. A su vez, esta reducción en el volumen cerebral se ha asociado con una disminución en la capacidad funcional y una mayor susceptibilidad a trastornos neurodegenerativos. Aunque la pérdida de sustancia gris es una parte esperada del envejecimiento, su aceleración o aumento de severidad puede indicar un proceso patológico que afecta la calidad de vida de las personas mayores.-
La reducción de tejido cerebral, en particular de la sustancia gris, tiene un impacto directo en el sistema músculo esquelético y asociado al movimiento. La sustancia gris contiene neuronas que generan la transmisión y procesamiento de información en el cerebro, esto incluye la coordinación de los movimientos. A medida que se reduce el volumen de la sustancia gris, la capacidad del cerebro para controlar y coordinar el movimiento se ve afectada, lo que contribuye a la disfunción motora. Este deterioro en las estructuras cerebrales encargadas de la motricidad incrementa el riesgo de caídas y reduce la autonomía de las personas mayores.
Una de las manifestaciones clínicas más comunes de la disfunción motora en el envejecimiento es la alteración en la marcha, caracterizada frecuentemente por una disminución en la velocidad. Esta reducción en la velocidad de marcha no solo es un indicador de deterioro motor, sino que también se ha vinculado con un mayor riesgo de deterioro cognitivo y problemas de salud adicionales. La velocidad de marcha se ha catalogado como el sexto “signo vital” en las personas mayores y su enlentecimiento se considera un signo temprano de fragilidad y está asociada con un pronóstico desfavorable en términos de movilidad y capacidad funcional.- Entender la relación entre la pérdida de sustancia gris y la disminución de la velocidad de marcha es fundamental para desarrollar intervenciones que puedan mejorar la calidad de vida y la autonomía esta población. A razón de esto, la presente revisión tuvo como objetivo analizar la evidencia sobre la relación entre reducción de la sustancia gris y la disminución de la velocidad de la marcha en personas mayores mediante una revisión sistemática de la literatura.
MATERIAL Y MÉTODOS
Diseño
Estudio de enfoque cualitativo y diseño documental, corresponde a una revisión sistemática de la literatura siguiendo los lineamientos de la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses Guidelines (PRISMA).
Búsqueda de estudios
La búsqueda fue realizada por los cuatro autores. Esta búsqueda se desarrolló a través de las bases de datos: Medline (PubMed) y Scopus, con fecha límite 30 de octubre de 2024. Los términos y combinación de operadores fue la siguiente: (gray matter) AND (gait speed) AND (elderly OR older people OR aged).
Criterios de elegibilidad
Se utilizaron los siguientes criterios para seleccionar los estudios para esta revisión sistemática: I) muestra de personas mayores de 60 años, hombres o mujeres; II) con diseño observacional; III) en los que se relacione densidad de materia gris y la velocidad de la marcha; IV) estudios publicados en idioma inglés o español. Se excluyeron I) estudios publicados sin acceso completo al texto y II) presentaciones en congresos, cartas al editor, tesis y libros.
Selección de estudios
Los estudios que se consideraron elegibles para su inclusión se ingresaron en la aplicación Rayyan QCRI, una aplicación que ayuda en el proceso de selección de artículos, optimiza el tiempo de selección y permite tareas colaborativas (disponible en http://rayyan.qcri.org). Primero, se eliminaron las referencias duplicadas y aquellas con etiquetas de diseños de investigación distinta mediante la aplicación. Luego, tres investigadores independientes revisaron los artículos en tres fases: lectura de títulos, lectura de resúmenes y lectura de textos completos; esto para identificar los artículos que cumplían con los criterios de elegibilidad. Se consideró verificar las listas de referencias en busca de artículos relevantes que pudieran incluirse.
Evaluación del riesgo de sesgo y calidad de la evidencia
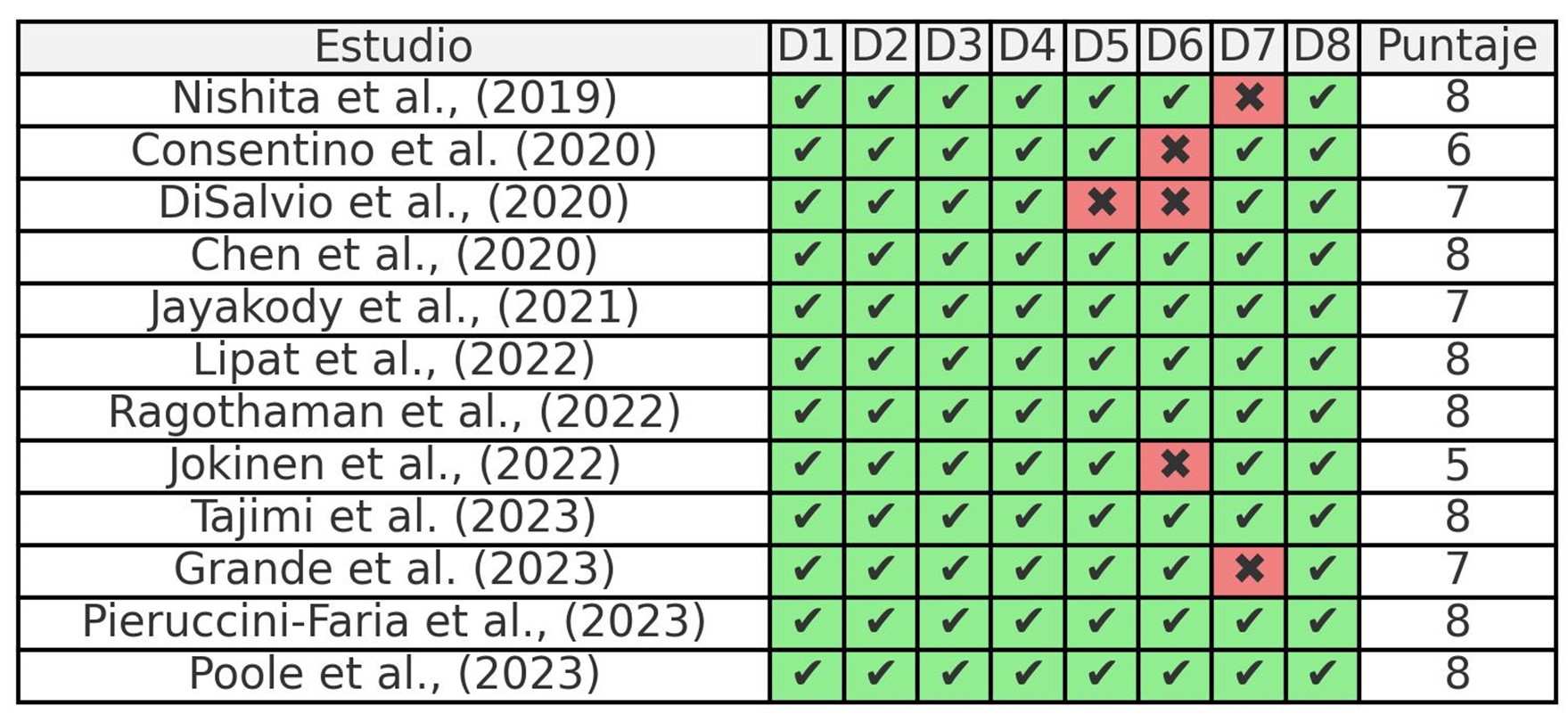
Cada artículo incluido fue evaluado en calidad metodológica y riesgo de sesgo de forma autónoma por tres autores, utilizando la escala Critical Appraisal Checklist for Analytical Cross-Sectional Studies del Joanna Briggs Institute (JBI), la cual es una herramienta desarrollada específicamente para evaluar la calidad metodológica de estudios de diseño transversal. Esta lista de verificación permite valorar aspectos clave del diseño y ejecución de estudios transversales, identificando potenciales fuentes de sesgo y problemas de validez que podrían afectar los resultados. La escala contiene una lista de ocho preguntas diseñadas para evaluar de manera específica la calidad del diseño, los métodos y los análisis de los estudios. Cada pregunta se responde de acuerdo con los criterios proporcionados, con posibles respuestas como "Sí", "No", "No aplica" o "No claro", dependiendo de la información presentada en el artículo. Un evaluador independiente aplicó la evaluación de riesgo de sesgo (KCL), los resultados de este análisis se presentan en la Figura 1.
Extracción y análisis de datos
La siguiente información se extrajo de los estudios incluidos: autor(es) y año de publicación, país de ejecución del estudio, Diseño, participantes, edad de los participantes, medición de la sustancia gris, medición de la velocidad de la marcha y principales hallazgos del estudio. Los autores DAD, KCR y KCL utilizaron una plantilla de Excel para extraer la información relevante de cada artículo y el análisis obtenido se presenta en la Tabla 1.
RESULTADOS
Búsqueda de la literatura
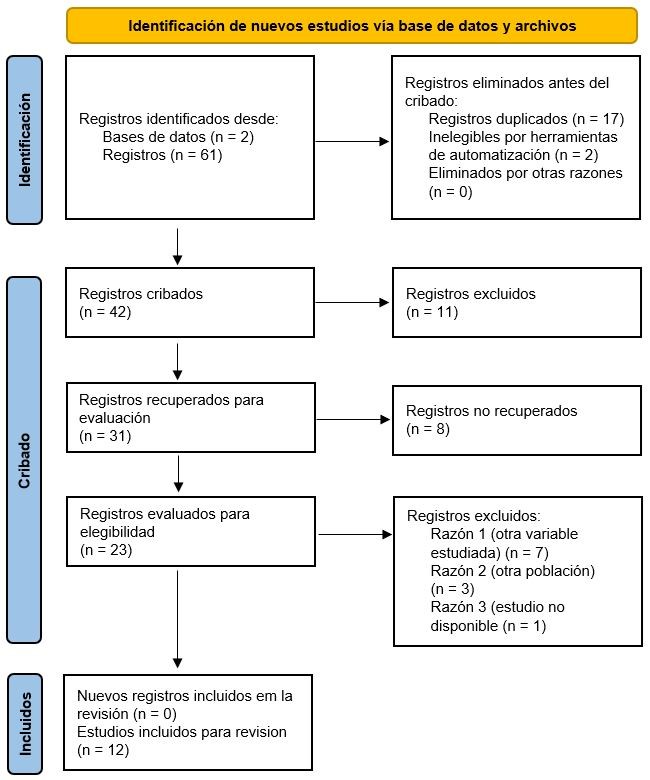
Se recuperaron un total de 61 artículos de Pubmed y Scopus. Entre todos los artículos, se eliminaron 17 duplicados en ambas bases de datos y 2 artículos se eliminaron con uso de herramientas automáticas, detectando mediante etiquetas diseños observacionales. Después de leer 42 títulos, se excluyeron 11 artículos y luego de leer 31 resúmenes, se excluyeron 8 que no cumplían con los criterios de inclusión o no contenían los términos de búsqueda. Finalmente, fueron 23 artículos los que quedaron para lectura a texto completo y en los cuáles se indagó la coherencia de los objetivos del estudio y los métodos que aportarían a responder la pregunta de investigación. El proceso de selección y sus fases se resumen en el diagrama de flujo de PRISMA en la Figura 2.
Características de los estudios y participantes
Se seleccionaron 23 estudios para lectura texto completo, sin embargo, de estos se incluyeron sólo 12 estudios que cumplieron con los criterios de inclusión, se encontraban disponibles a texto completo y declararon la relación entre la densidad de materia gris y la velocidad de la marcha en personas mayores de 60 años, las principales características de los artículos incluidos se presentan en la Tabla 1. El tamaño de muestra comunicada osciló entre 40 y 1112 individuos, los 12 artículos analizados sumaron un total de 4042 individuos. Los estudios fueron desarrollados principalmente en América del Norte (n=6, Estados Unidos y Canadá), también en Europa (n=3, Suiza, Finlandia e Italia), Asía (n=2, Japón) y Oceanía (n=1, Australia). Todos los estudios correspondían a estudios observacionales, 5 estudios transversales, 5 de cohorte y 2 estudios de casos y controles). Todos los estudios utilizaron resonancia magnética para la valoración de densidad de sustancia gris, la mayoría utilizaron equipos Siemens Magnetom y una menor cantidad equipos de Philips Achieva. Todos los estudios utilizaron plataforma de caminata para valorar la velocidad de la marcha, sin embargo, oscilaron las longitudes de la plataforma, de 2,4 metros a 20 metros, sólo un estudio no definía la prueba física utilizada, pero su reporte correspondía a la medida cuantitativa de metros por segundo.
Síntesis de principales hallazgos
Los hallazgos principales indicaron una relación consistente entre la reducción de la sustancia gris y la disminución de la velocidad de marcha. Las áreas cerebrales más frecuentemente implicadas incluyeron el hipocampo, el lóbulo frontal y temporal, la amígdala, el cerebelo y los ganglios basales. Por otro lado, los estudios que exploraron el impacto de mayores volúmenes de sustancia gris sugirieron un mejor rendimiento motor, particularmente en tareas de velocidad de marcha y pruebas dinámicas (por ejemplo, índice dinámico de marcha y prueba de cuatro pasos cuadrados).
Además, se observó que los grupos clasificados como "frágiles" o con deterioro cognitivo y motor combinados presentaban los mayores déficits estructurales, incluyendo una reducción significativa en el volumen total del cerebro, el hipocampo y la sustancia gris cerebelar, así como un aumento en las lesiones de materia blanca y agrandamiento de ventrículos. Por el contrario, los participantes con solo deterioro cognitivo mostraron una mayor pérdida específica en el hipocampo, mientras que aquellos con problemas motores tuvieron un mayor nivel de lesiones en la materia blanca.
Cabe destacar que las medidas anticipatorias en la marcha, particularmente bajo condiciones de doble tarea, también estuvieron vinculadas con volúmenes reducidos en áreas específicas como el giro frontal inferior y la corteza entorrinal, lo que refleja la influencia de la conectividad cerebral en ajustes motores complejos. Finalmente, los estudios incluyeron poblaciones mayoritariamente saludables, pero algunos reportaron subgrupos con deterioro cognitivo leve, enfermedad de Alzheimer o fragilidad avanzada, lo que resalta la heterogeneidad de las muestras y la necesidad de considerar estas diferencias al interpretar los resultados.
DISCUSIÓN
La revisión de literatura científica afirma que existe una relación entre la pérdida de la sustancia gris cerebral y la disminución de la velocidad de la marcha en personas mayores,- estando principalmente en centrada en estudios de salud neurológica y salud geriátrica. Es posible explicar esta relación, debido a que la sustancia gris contiene cuerpos neuronales involucrados en la planificación, la integración sensorial y el control motor.
La evidencia ya afirmaba que a medida que se envejece, la pérdida de sustancia gris en ciertas áreas cerebrales se asocia con un rendimiento motor disminuido y, en consecuencia, con una reducción en una de las actividades más importantes para el ser humano, la marcha.- La revisión actual, permite entender la relación más a fondo, pues los estudios de neuroimagen y de seguimiento longitudinal han identificado una correlación entre la disminución de la sustancia gris en áreas específicas y la velocidad de la marcha, sugiriendo que el mantenimiento de la salud de estas estructuras podría ser clave para preservar una función adecuada en el proceso de envejecimiento.
La reducción de la sustancia gris en áreas como el lóbulo frontal, parietal, temporal y estructuras subcorticales afecta el procesamiento sensorial, la memoria y la función motora, esenciales para mantener la estabilidad y velocidad de la marcha. Estos cambios neuroanatómicos reducen la capacidad del cerebro para coordinar los movimientos necesarios para una marcha fluida y rápida, y son especialmente evidentes en condiciones de ejecución de la marcha y una tarea cognitiva adicional.,, Esta disminución de la velocidad de la marcha se asocia también con déficits en la corteza prefrontal y temporal, áreas críticas para la planificación y control motor. La corteza prefrontal está involucrada en funciones cognitivas como la toma de decisiones y la memoria de trabajo, su atrofia puede afectar la capacidad de iniciar y coordinar el movimiento, lo cual puede influir indirectamente en la marcha.,
Las principales zonas cerebrales en las que se presenta una reducción de la sustancia gris son el hipocampo (6 estudios),,,,,, el lóbulo frontal temporal (5 estudios),,,,,, la amígdala (3 estudios),,, el lóbulo frontal (3 estudios),, , la circunvolución parahipocampal (3 estudios),,, el cerebelo (3 estudios),,, la ínsula (2 estudios),, los ganglios basales (2 estudios),, la circunvolución cingulada (2 estudios),, el lóbulo parietal (2 estudios), y el giro fulsiforme (2 estudios),. Estos hallazgos destacan regiones cerebrales clave, particularmente las involucradas en la memoria (hipocampo y lóbulo temporal), funciones motoras (lóbulo parietal y cerebelo) y control emocional (amígdala), todas las cuales afectan la velocidad de marcha. Paralelamente, dentro de los estudios incluidos en la revisión se muestra una mayor densidad de materia gris y un mejor rendimiento en la velocidad de marcha, las zonas más frecuentes de estos hallazgos son el lóbulo temporal, el lóbulo frontal y el hipocampo, coincidiendo estas áreas cerebrales, en la comunicación de esta relación entre ambas variables en sentido inverso.
La presente revisión tuvo limitaciones y una de ellas fue el sesgo de edad de los estudios incluidos, pues en el título y resumen se indicaba a estudios con muestras de personas mayores, y al revisar el artículo completo, algunos de ellos incluían a personas menores de 60 años. Otra limitación es la diferencia de instrumentos para valorar la velocidad de la marcha, y si bien, todos cuentan con protocolos de validación, la diferencia de longitud de la prueba de marcha puede significar sesgo en el resultado final comunicado. Por otro lado, también es una limitación las características de las muestras de personas mayores, en los estudios de Consentino et al., (2020) y de Pieruccini-Faria et al., (2023) se declaró que el grupo control tenía deterioro cognitivo leve y el estudio de Ragothaman et al., (2022) se declaró que el grupo control eran personas mayores con Alzheimer; los demás estudios no definieron grupos con patologías específicas y se interpretó que correspondían a una muestra aparentemente sana.
La principal fortaleza de esta revisión sistemática, es el enfoque en establecer la relación entre la reducción de sustancia gris y la disminución de la velocidad de la marcha. Si bien los estudios previos declaran que esta última es multifactorial, resaltan los factores biomecánicos y músculo esqueléticos, pero no desde una comprensión neurofisiológica. Otra fortaleza es que el análisis de evidencia se realizó en la base de datos de salud más grande a nivel mundial como lo es Medline y en otra donde el índice temático también acoge a una gran proporción de estudios en salud como lo es Scopus.
La valoración periódica de la marcha puede ser útil para monitorear el estado neurológico de las personas mayores y puede ayudar a ajustar las estrategias de intervención para mantener su movilidad y autonomía., La comprensión de esta relación, debe reforzar la necesidad de abordar tanto la función motora como cognitiva en personas mayores, en específico, de llevar a cabo programas físico-cognitivo dual, que incluyan ejercicios físicos con tareas de memoria o atención.,, La literatura también indica que realizar periódicamente ejercicios de tipo aeróbicos y de resistencia de moderada a alta intensidad, es una de las intervenciones más efectivas para preservar el volumen de sustancia gris en personas mayores. Ambos tipos de ejercicios potencian la neurogénesis, la plasticidad cerebral y la vascularización cerebral, especialmente en áreas como el hipocampo y los lóbulos frontales.-
CONCLUSIÓN
Los resultados de esta revisión sistemática refuerzan la existencia de una relación significativa entre la reducción del volumen de sustancia gris cerebral y la disminución de la velocidad de marcha en personas mayores. Este hallazgo destaca la importancia de valorar la marcha no solo como un indicador funcional, sino también como un reflejo de la integridad estructural del sistema nervioso central.
La evidencia recopilada sugiere que las regiones cerebrales más involucradas en esta relación incluyen áreas clave como el hipocampo, el lóbulo frontal y temporal, y el cerebelo, las cuales desempeñan un papel central en el control motor, la planificación y la integración sensorial. Además, la interacción entre las reducciones de sustancia gris y el aumento de lesiones en la materia blanca enfatiza la naturaleza multifactorial del deterioro motor asociado al envejecimiento.
Estos hallazgos subrayan la relevancia clínica de incorporar evaluaciones regulares de la marcha en la práctica médica geriátrica, ya que podrían ser herramientas útiles para monitorear cambios neurológicos tempranos y diseñar estrategias de intervención integrales. Asimismo, la implementación de programas de entrenamiento físico-cognitivo dual y ejercicios aeróbicos y de resistencia se presenta como una posible vía para mitigar la progresión del deterioro neurológico y motor, contribuyendo al mantenimiento de la autonomía y la calidad de vida de las personas mayores.
En futuras investigaciones, se recomienda explorar más profundamente las diferencias según género, factores genéticos y otras características individuales, así como estandarizar las mediciones para reducir la heterogeneidad metodológica entre estudios.
REFERENCIAS
1.
Rosso AL, Studenski SA, Chen WG, Aizenstein HJ, Alexander NB, Bennett DA, et al. Aging, the Central Nervous System, and Mobility. The Journals of Gerontology: Series A. 2013 Jul 10;68(11):1379–86. Disponible en: http://dx.doi.org/10.1093/gerona/glt089
2.
Ramanoël S, Hoyau E, Kauffmann L, Renard F, Pichat C, Boudiaf N, et al. Gray Matter Volume and Cognitive Performance During Normal Aging. A Voxel-Based Morphometry Study. Frontiers in Aging Neuroscience. 2018 Aug 3;10. Disponible en: http://dx.doi.org/10.3389/fnagi.2018.00235
3.
Wu Z, Peng Y, Hong M, Zhang Y. Gray Matter Deterioration Pattern During Alzheimer’s Disease Progression: A Regions-of-Interest Based Surface Morphometry Study. Frontiers in Aging Neuroscience. 2021 Feb 3;13. Disponible en http://dx.doi.org/10.3389/fnagi.2021.593898
4.
Xiao Y, Gao L, Hu Y. Disrupted single-subject gray matter networks are associated with cognitive decline and cortical atrophy in Alzheimer’s disease. Frontiers in Neuroscience. 2024 May 10;18. Disponible en: http://dx.doi.org/10.3389/fnins.2024.1366761
5.
Zullo A, Fleckenstein J, Schleip R, Hoppe K, Wearing S, Klingler W. Structural and Functional Changes in the Coupling of Fascial Tissue, Skeletal Muscle, and Nerves During Aging. Frontiers in Physiology. 2020 Jun 24;11. Disponible en: http://dx.doi.org/10.3389/fphys.2020.00592
6.
Atkinson HH, Rosano C, Simonsick EM, Williamson JD, Davis C, Ambrosius WT, et al. Cognitive Function, Gait Speed Decline, and Comorbidities: The Health, Aging and Body Composition Study. The Journals of Gerontology: Series A [Internet]. 2007 Aug 1;62(8):844–50. Available from: http://dx.doi.org/10.1093/gerona/62.8.844
7.
Bortone I, Sardone R, Lampignano L, Castellana F, Zupo R, Lozupone M, et al. How gait influences frailty models and health‐related outcomes in clinical‐based and population‐based studies: a systematic review. Journal of Cachexia, Sarcopenia and Muscle. 2021 Feb 16;12(2):274–97. Disponible en: http://dx.doi.org/10.1002/jcsm.12667
8.
Middleton A, Fritz SL, Lusardi M. Walking Speed: The Functional Vital Sign. Journal of Aging and Physical Activity. 2015 Apr;23(2):314–22. Disponible en: http://dx.doi.org/10.1123/japa.2013-0236
9.
Nishita Y, Nakamura A, Kato T, Otsuka R, Iwata K, Tange C, et al. Links Between Physical Frailty and Regional Gray Matter Volumes in Older Adults: A Voxel-Based Morphometry Study. Journal of the American Medical Directors Association. 2019 Dec;20(12):1587-1592.e7. Disponible en: http://dx.doi.org/10.1016/j.jamda.2019.09.001
10.
Cosentino E, Palmer K, Della Pietà C, Mitolo M, Meneghello F, Levedianos G, et al. Association Between Gait, Cognition, and Gray Matter Volumes in Mild Cognitive Impairment and Healthy Controls. Alzheimer Disease & Associated Disorders. 2020 Jan 21;34(3):231–7. Disponible en: http://dx.doi.org/10.1097/wad.0000000000000371
11.
DiSalvio NL, Rosano C, Aizenstein HJ, Redfern MS, Furman JM, Jennings JR, et al. Gray Matter Regions Associated With Functional Mobility in Community‐Dwelling Older Adults. Journal of the American Geriatrics Society. 2019 Dec 30;68(5):1023–8. Disponible en: http://dx.doi.org/10.1111/jgs.16309
12.
Chen N, Rosano C, Karim HT, Studenski SA, Rosso AL. Regional Gray Matter Density Associated With Fast-Paced Walking in Older Adults: A Voxel-Based Morphometry Study. Melzer D, editor. The Journals of Gerontology: Series A. 2020 Apr 14;75(8):1530–6. Disponible en: http://dx.doi.org/10.1093/gerona/glaa091
13.
Jayakody O, Breslin M, Beare R, Blumen HM, Srikanth VK, Callisaya ML. Regional Associations of Cortical Thickness With Gait Variability—The Tasmanian Study of Cognition and Gait. Newman A, editor. The Journals of Gerontology: Series A. 2020 May 8;75(8):1537–44. Disponible en: http://dx.doi.org/10.1093/gerona/glaa118
14.
Lipat AL, Clark DJ, Hass CJ, Cruz-Almeida Y. Gait subgroups among older adults with chronic pain differ in cerebellum and basal ganglia gray matter volumes. Experimental Gerontology. 2022 Jun;163:111773. Disponible en: http://dx.doi.org/10.1016/j.exger.2022.111773
15.
Ragothaman A, Miranda-Dominguez O, Brumbach BH, Giritharan A, Fair DA, Nutt JG, et al. Relationship Between Brain Volumes and Objective Balance and Gait Measures in Parkinson’s Disease. Journal of Parkinson’s Disease. 2022 Jan 21;12(1):283–94. Disponible en: http://dx.doi.org/10.3233/jpd-202403
16.
Jokinen H, Laakso HM, Ahlström M, Arola A, Lempiäinen J, Pitkänen J, et al. Synergistic associations of cognitive and motor impairments with functional outcome in covert cerebral small vessel disease. European Journal of Neurology. 2021 Sep 26;29(1):158–67. Disponible en: http://dx.doi.org/10.1111/ene.15108
17.
Tajimi T, Furuta Y, Hirabayashi N, Honda T, Hata J, Ohara T, et al. Association of gait speed with regional brain volumes and risk of dementia in older Japanese: The Hisayama study. Archives of Gerontology and Geriatrics. 2023 Mar;106:104883. Disponible en: http://dx.doi.org/10.1016/j.archger.2022.104883
18.
Grande G, Vetrano DL, Kalpouzos G, Welmer AK, Laukka EJ, Marseglia A, et al. Brain Changes and Fast Cognitive and Motor Decline in Older Adults. Lipsitz LA, editor. The Journals of Gerontology: Series A. 2022 Aug 29;78(2):326–32. Disponible en: http://dx.doi.org/10.1093/gerona/glac177
19.
Pieruccini-Faria F, Hassan Haddad SM, Bray NW, Sarquis-Adamson Y, Bartha R, Montero-Odasso M. Brain Structural Correlates of Obstacle Negotiation in Mild Cognitive Impairment: Results from the Gait and Brain Study. Gerontology. 2023;69(9):1115–27. Disponible en: http://dx.doi.org/10.1159/000530796
20.
Poole VN, Oveisgharan S, Yu L, Dawe RJ, Leurgans SE, Zhang S, et al. Volumetric brain correlates of gait associated with cognitive decline in community-dwelling older adults. Frontiers in Aging Neuroscience. 2023 Oct 4;15. Disponible en: http://dx.doi.org/10.3389/fnagi.2023.1194986
21.
Riaz U, Razzaq FA, Areces-Gonzalez A, Piastra MC, Vega MLB, Paz-Linares D, et al. Automatic quality control of the numerical accuracy of EEG lead fields. NeuroImage. 2023 Jun;273:120091. Disponible en: http://dx.doi.org/10.1016/j.neuroimage.2023.120091
22.
Herold F, Törpel A, Schega L, Müller NG. Functional and/or structural brain changes in response to resistance exercises and resistance training lead to cognitive improvements – a systematic review. European Review of Aging and Physical Activity. 2019 Jul 10;16(1). Disponible en: http://dx.doi.org/10.1186/s11556-019-0217-2